Dua hal penting mengenai atom menurut Dalton :
- Atom-atom suatu unsur semuanya serupa dan tidak dapat berubah menjadi atom unsur lain, misalnya atom perak tidak berubah menjadi atom besi.
- Dua atom atau lebih dari unsur-unsur berlainan dapat membentuk molekul. Misalnya atom hydrogen dan atom oksigen dapat bersenyawa membentuk molekul air ( H2O )
1. Tidak dapat menjelaskan sifat kelistrikan suatu atom
- Bola padat /pejal bermuatan positif dimana elektron tersebar merata diseluruh bagian atom
- Model atom J.J Thompson dikenal juga dengan model atom ROTI KISMIS
- Secara keseluruhan atom bersifat netral

- Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti / kestabilan atom
- Tidak dapat menjelaskan spektrum garis atom hidrogen
Kelemahan model atom Niels Bohr :
Tidak dapat menjelaskan spektrum atom-atom yang berelektron banyak
Contoh :
Tentukan jumlah proton, elektron dan neutron dari :
Maksimal elektron yang dapat diisi pada kulit dapat dirumuskan :
- diisi sebanyak elektron sisa jika < 8
- diisi 8 elektron. jika elektron sisa > 8 maka dimasukkan ke kulit berikutnya
- Diisi 8 elektron jika elektron sisa < 18, elektron sisa masuk ke kulit N
- Diisi 18 elektron jika elektron sisa lebih dari atau sama dengan 18
Contoh :
20 Ca = 2 8 8 2
34 Se = 2 8 18 6
(4) Kulit N

Periode : jumlah kulit yang terisi elektron
Golongan : elektron yang berada pada kulit paling luar ( elektron valensi), ditulis dengan angka romawi.
Contoh :
Ada tiga sub kulit yang terisi elektron sehingga Na termasuk :
- Periode : 3
- Golongan : I A
Terbagi dua yaitu :
a. Kation = ion bermuatan positif ( melepas elektron)
Contoh : Na+, Mg2+, Al3+
b. Anion = ion bermuatan negatif ( menangkap elektron)
Contoh : F-, Cl-, SO42-,
Molekul terbagi dua : molekul unsur dan molekul senyawa
Molekul unsur terdiri dari unsur-unsur yang sejenis
Contoh : H2, O3, Cl2
Molekul senyawaterdiri dari unsur-unsur yang berbeda
- Terjadi pada LOGAM + NON LOGAM
- Serah terima elektron
(b) ikatan kovalen
Terjadi pada NON LOGAM + NON LOGAM
Pemakaian bersama pasangan elektron
Contoh : H2, Cl2, H2O, HCl, O2
Baca juga :












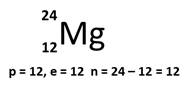



















Silahkan Corat Coret dibawah